Configuración
Electrónica
¿Qué es la Configuración Electrónica?
La Configuración Electrónica de los elementos es la disposición de todos los electrones de un elemento en los niveles y subniveles energéticos (orbitales). El llenado de estos orbitales se produce en orden creciente de energía, es decir, desde los orbitales de menor energía hacia los de mayor energía.
Recordemos que los orbitales son las regiones alrededor del núcleo de un átomo donde hay mayor probabilidad de encontrar los electrones.

La Configuración Electrónica de los elementos es la disposición de todos los electrones de un elemento en los niveles y subniveles energéticos (orbitales). El llenado de estos orbitales se produce en orden creciente de energía, es decir, desde los orbitales de menor energía hacia los de mayor energía.
Recordemos que los orbitales son las regiones alrededor del núcleo de un átomo donde hay mayor probabilidad de encontrar los electrones.
¿Cómo se escribe la Configuración Electrónica?
La Configuración Electrónica se escribe ubicando la totalidad de los electrones de un átomo o ion en sus orbitales o subniveles de energía.
Recordemos que existen 7 niveles de energía: 1, 2, 3, 4, 5, 6 y 7. Y cada uno de ellos tiene, a su vez, hasta 4 subniveles de energía denominados s, p, d y f.
Así, el nivel 1 contiene solamente al subnivel s; el nivel 2 contiene subniveles s y p; el nivel 3 contiene subniveles s, p y d; y los niveles 4 a 7 contienen subniveles s, p, d y f.

¿Cuál es la cantidad máxima de electrones que puede alojar cada subnivel?
El subnivel s aloja un máximo de 2 electrones.
El subnivel p aloja un máximo de 6 electrones.
El subnivel d aloja un máximo de 10 electrones.
El subnivel f aloja un máximo de 14 electrones.

¿Cuál es la cantidad máxima de electrones que puede alojar cada subnivel?
El subnivel s aloja un máximo de 2 electrones.
El subnivel p aloja un máximo de 6 electrones.
El subnivel d aloja un máximo de 10 electrones.
El subnivel f aloja un máximo de 14 electrones.
¿Cómo se utiliza el Diagrama de Moeller o Regla de las Diagonales?
El diagrama de Moeller o Regla de las diagonales se utiliza para recordar el orden de llenado de los orbitales atómicos. Es, simplemente, una regla mnemotécnica.
Es la siguiente:

Regla de las Diagonales o Diagrama de Moeller:


Regla de las Diagonales o Diagrama de Moeller:

La forma de construir este diagrama es escribir los niveles de energía atómicos (del 1 al 7) y los correspondientes subniveles a su lado. Luego se trazan líneas diagonales desde arriba hacia abajo.
No debes recordarlo de memoria, ahora ya sabes construirlo, de modo que el día del examen, lo puedes escribir y luego utilizar para resolver los ejercicios.
¿Conoces nuestras clases particulares online? Entérate cómo cientos de estudiantes están cambiando su manera de aprender.
¿Cómo se utiliza el Diagrama de Moeller o Regla de las Diagonales?
Para utilizar la regla de las diagonales simplemente debes seguir las líneas diagonales del diagrama desde arriba hacia abajo. Eso marcará el orden de llenado de los subniveles de energía. La cantidad de electrones se escribe como superíndice. Una vez que un subnivel de energía está "completo" de electrones se pasa al subnivel siguiente
Ejemplos de Configuración Electrónica
Escribir la Configuración Electrónica del Manganeso (Mn):
PASO 1: Lo primero que debemos conocer es el Número Atómico (Z) del elemento en cuestión, en este caso, el Manganeso el cual nos indica la cantidad de protones.
Al tratarse de un átomo neutro, la cantidad de protones será igual a la cantidad de electrones.
PASO 2: El siguiente paso será ubicar la totalidad de los electrones en los orbitales correspondientes utilizando la Regla de las Diagonales.
Veamos: El Manganeso (Mn) tiene un número atómico Z=25, es decir, que tiene 25 protones y 25 electrones.
Siguiendo la Regla de las Diagonales escribimos la configuración electrónica (CE) del Mn de la siguiente manera:

Escribir la Configuración Electrónica del Carbono (C)
El átomo de Carbono tiene un número atómico (Z) de 6. Es decir, tiene 6 protones en su núcleo. Al tratarse de un átomo neutro tiene también 6 electrones alrededor del núcleo, distribuidos en distintos niveles y subniveles de energía. Utilizando la regla de las diagonales o Diagrama de Moeller escribimos la Configuración Electrónica (CE) del Carbono:

Configuración Electrónica del Hidrógeno (H)
El átomo de Hidrógeno tiene un número atómico (Z) de 1.
Es decir, tiene 1 protón en su núcleo. Al tratarse de un átomo neutro tiene también 1 electrón alrededor del núcleo.
Utilizando la regla de las diagonales o Diagrama de Moeller escribimos la Configuración Electrónica (CE) del Hidrógeno:

Y ahora ... ¡Comprueba si has entendido el tema!
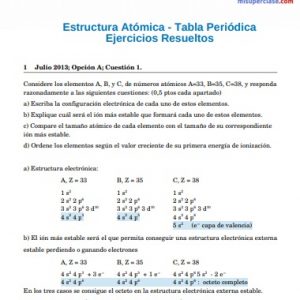
Ejercicios Resueltos de Configuración electrónica
Escribe la Configuración Electrónica (CE) de los siguientes átomos o iones:
a) Átomo de sodio
b) Ion monopositivo de Sodio
c) Átomo de Flúor
d) Ion mononegativo de Flúor
Datos: Número atómico (Z) del Sodio = 11 Número atómico (Z) del Flúor = 9
Respuestas:
a) Átomo de sodio (Na). Z=11, entonces tiene 11 protones y 11 electrones, ya que es NEUTRO. Siguiendo el diagrama de Moeller escribimos la Configuración Electrónica del Sodio, ubicando los 11 electrones en los orbitales:
Configuración Electrónica del Sodio:

b) Ion monopositivo de Sodio ¿Qué quiere decir que sea un Ion monopositivo de sodio?
Quiere decir que es un átomo cargado positivamente. Y al ser MONOpositivo sabemos que tiene UNA carga positiva, es decir: Na+.
Es un ion (átomo cargado). Más específicamente un CATIÓN: átomo cargado positivamente. Para llegar a tener esta carga, el átomo de Na (que tenía 11 protones y 11 electrones) perdió un electrón (carga negativa), por lo que se ha quedado con 11 protones (cargas positivas) y 10 electrones (cargas negativas). Osea que tiene una carga positiva más que las negativas, por esa razón es un ion monopositivo, y se escribe: Na+
Entonces debemos escribir la configuración electrónica de este ION MONOPOSITIVO DE SODIO, ubicando sus 10 electrones en los orbitales.
Para esto utilizamos el diagrama de Moeller o regla de las diagonales:
Configuración Electrónica del ion monopositivo de Sodio:

c) Átomo de Flúor (F) F Z=9, entonces tiene 9 protones y 9 electrones ya que es un átomo NEUTRO.
Siguiendo el diagrama de Moeller escribimos la Configuración Electrónica del Flúor, ubicando los 9 electrones en los orbitales:
Configuración Electrónica del Flúor:

d) Ion mononegativo de Flúor ¿Qué quiere decir que sea un Ion mononegativo de Flúor?
Quiere decir que es un átomo cargado negativamente. Y al ser MONOnegativo sabemos que tiene UNA carga negativa, es decir: F-. Es un ion (átomo cargado). Más específicamente un ANIÓN: átomo cargado negativamente. Para llegar a tener esta carga, el átomo de F (que tenía 9 protones y 9 electrones) ganó un electrón (carga negativa), por lo que se ha quedado con 9 protones (cargas positivas) y 10 electrones (cargas negativas).
Osea que tiene una carga negativa más que las positivas, por esa razón es un ion mononegativo, y se escribe: F-
Entonces debemos escribir la configuración electrónica de este ION MONONEGATIVO DE FLÚOR, ubicando sus 10 electrones en los orbitales. Para esto utilizamos el diagrama de Moeller o regla de las diagonales:
Configuración Electrónica del ion mononegativo de Flúor:

Observemos que la Configuración electrónica del Na+ y del F- son iguales. Esto se debe a que son iones isoelectrónicos.
Ejercicios Resueltos de Configuración electrónica
Escribe la Configuración Electrónica (CE) de los siguientes átomos o iones:
a) Átomo de sodio
b) Ion monopositivo de Sodio
c) Átomo de Flúor
d) Ion mononegativo de Flúor
Datos: Número atómico (Z) del Sodio = 11 Número atómico (Z) del Flúor = 9
Respuestas:
a) Átomo de sodio (Na). Z=11, entonces tiene 11 protones y 11 electrones, ya que es NEUTRO. Siguiendo el diagrama de Moeller escribimos la Configuración Electrónica del Sodio, ubicando los 11 electrones en los orbitales:
Configuración Electrónica del Sodio:

b) Ion monopositivo de Sodio ¿Qué quiere decir que sea un Ion monopositivo de sodio?
Quiere decir que es un átomo cargado positivamente. Y al ser MONOpositivo sabemos que tiene UNA carga positiva, es decir: Na+.
Es un ion (átomo cargado). Más específicamente un CATIÓN: átomo cargado positivamente. Para llegar a tener esta carga, el átomo de Na (que tenía 11 protones y 11 electrones) perdió un electrón (carga negativa), por lo que se ha quedado con 11 protones (cargas positivas) y 10 electrones (cargas negativas). Osea que tiene una carga positiva más que las negativas, por esa razón es un ion monopositivo, y se escribe: Na+
Entonces debemos escribir la configuración electrónica de este ION MONOPOSITIVO DE SODIO, ubicando sus 10 electrones en los orbitales.
Para esto utilizamos el diagrama de Moeller o regla de las diagonales:
Configuración Electrónica del ion monopositivo de Sodio:

c) Átomo de Flúor (F) F Z=9, entonces tiene 9 protones y 9 electrones ya que es un átomo NEUTRO.
Siguiendo el diagrama de Moeller escribimos la Configuración Electrónica del Flúor, ubicando los 9 electrones en los orbitales:
Configuración Electrónica del Flúor:

d) Ion mononegativo de Flúor ¿Qué quiere decir que sea un Ion mononegativo de Flúor?
Quiere decir que es un átomo cargado negativamente. Y al ser MONOnegativo sabemos que tiene UNA carga negativa, es decir: F-. Es un ion (átomo cargado). Más específicamente un ANIÓN: átomo cargado negativamente. Para llegar a tener esta carga, el átomo de F (que tenía 9 protones y 9 electrones) ganó un electrón (carga negativa), por lo que se ha quedado con 9 protones (cargas positivas) y 10 electrones (cargas negativas).
Osea que tiene una carga negativa más que las positivas, por esa razón es un ion mononegativo, y se escribe: F-
Entonces debemos escribir la configuración electrónica de este ION MONONEGATIVO DE FLÚOR, ubicando sus 10 electrones en los orbitales. Para esto utilizamos el diagrama de Moeller o regla de las diagonales:
Configuración Electrónica del ion mononegativo de Flúor:

Observemos que la Configuración electrónica del Na+ y del F- son iguales. Esto se debe a que son iones isoelectrónicos.
¿Qué son los iones isoelectrónicos?
Los iones isoelectrónicos son iones (átomos con carga positiva o negativa) de distintos elementos químicos que tienen igual número de electrones. Pero, al tratarse de distintos elementos químicos, tienen distinto número atómico, es decir, distinto número de protones.
Autora de este artículo: María Cecilia
Es Bioquímica, da clases particulares de Química, Biología, Biofísica, Bioquímica, Fisiología, Física desde hace 12 años. Nivel secundario, Bachillerato, Terciario y Universitario. Puedes elegir tomar clases particulares online con ella, ya que forma parte de nuestro equipo de profesores.
La clases son de 60 minutos con garantía de satisfacción

Autora de este artículo: María Cecilia
Es Bioquímica, da clases particulares de Química, Biología, Biofísica, Bioquímica, Fisiología, Física desde hace mas de 10 años. Nivel universitario y secundario. Puedes elegir tomar clases particulares online con ella, ya que forma parte de nuestro equipo de profesores.
La clases son de 60 minutos con garantía de satisfacción
¿Aún tienes dudas con éste u otros temas de química?
¡Puedes tomar clases particulares online mediante videollamada con un profesor y sacarte todas las dudas!