Tabla Periódica
Propiedades Periódicas
Train your brain. Test your brain.

GAMEOFBRAINS.CLUB
¿Qué es la Tabla Periódica, cómo se utiliza y para qué sirve?
La tabla periódica de los elementos es una disposición de los elementos químicos ordenados por su número atómico, configuración electrónica y propiedades químicas. Este ordenamiento muestra Propiedades Periódicas.
Cada elemento de la tabla períodica corresponde a un "cuadradito" de la tabla.
Está representado por su Símbolo Químico (una o dos letras). Debajo del símbolo aparece su nombre.
El número que se encuentra debajo del símbolo de cada elemento es su número atómico (Z) que corresponde a la cantidad de protones en su núcleo. Es característico de cada elemento, le da identidad al átomo.
El número que se encuentra en la parte superior de cada recuadro es la masa atómica relativa (Mr)
Aparecen también otros datos como la isótopos, electronegatividad, número de oxidación, y Configuración Electrónica en referencia al gas noble mas cercano. Situándose con el mousse encima de un elemento cualquiera, se despliega en la parte central de la tabla periódica una tabla con características del elemento en cuestión.
La tabla está formada por "columnas verticales" que se denominan GRUPOS y "filas horizontales" llamadas PERÍODOS.
El código de colores de la tabla indica el tipo de elemento (metal, no metal, metaloides, etc)
Aprende de manera fácil, rápida y divertida la Tabla Periódica
¿Qué son las Propiedades Periódicas?
Son las propiedades o características que tienen los elementos químicos, que varían en forma secuencial a traves de los grupos y períodos de la tabla periódica.
Para comprender las propiedades periódicas es importante tener claro qué pasa con los elementos de un mismo grupo y período dentro de la tabla periódica. Veamos la siguiente imagen:

En la imagen anterior están representados distintos núcleos atómicos, rodeados de orbitales en los que se hallan los electrones.
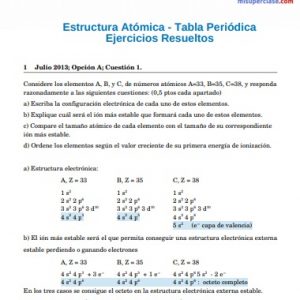
Los elementos de un mismo GRUPO tienen en común que en el Último Nivel de Energía tienen la misma cantidad de electrones. Por ejemplo, el Hidrógeno (H), Litio (Li) y Sodio (Na) tienen 1 electrón en su último nivel de energía.
Los elementos de un GRUPO se diferencian en que su Último Nivel de Energía es diferente entre ellos. Por ejemplo, el Último Nivel de Energía del Hidrógeno (H) es el 1; el del Litio (Li) es el 2; y el del Sodio (Na) es el 3.
Veamos esto escribiendo la Configuración Electrónica de cada uno de esos elementos:

Los elementos de un mismo PERÍODO tienen en común que el Último Nivel de Energía es el mismo. Por ejemplo, el Último Nivel de Energía del Litio (Li), Carbono (C), Nitrógeno (N), Oxígeno (O), Flúor (F) y Neón (Ne) es el 2.
Los elementos de un PERÍODO se diferencian en la cantidad de electrones que se ubican en su Último Nivel de Energía. Por ejemplo: el Litio (Li) tiene 1 electrón en su último nivel de energía, el Carbono (C) tiene 4 electrones en su último nivel de energía, y el Oxígeno (O) tiene 6 electrones en su último nivel de energía.
Veamos esto escribiendo la Configuración Electrónica de cada uno de esos elementos:

¿Cuáles son las Propiedades Periódicas?
Las propiedades periódicas son: Radio Atómico, Energía de Ionización, Electronegatividad, Afinidad electrónica, Radio Iónico. Veamos cada una de ellas y su variación a traves de la tabla periódica.
Radio Atómico
Es la distancia que hay desde el núcleo atómico hasta el último nivel de energía de un átomo. Otra definición es que el radio atómico es la mitad de la distancia entre dos núcleos atómicos idénticos. Esta última definición surge de la determinación experimental del Radio Atómico.
¿Cómo varía el Radio Atómico en la Tabla Periódica?
Si nos movemos de izquierda a derecha en un PERÍODO, la carga nuclear ( positiva ) va aumentando porque aumenta la cantidad de protones en el núcleo ( aumenta el Z ) entonces atrae con mayor fuerza a los electrones que se van agregando en ese mismo nivel de energía. Esta mayor fuerza hace que este último nivel de energía pase a estar más cerca del núcleo. De esta forma, disminuye el radio atómico.
Si nos movemos de arriba abajo en un GRUPO, los átomos tienen más niveles de energía ( uno más por cada período ). Cada nivel está más alejado que los anteriores y los electrones de los niveles que quedan en el medio ( electrones internos) "tapan" o "apantallan" la carga nuclear. Esto provoca que los electrones del último nivel de energía no se encuentren tan atraídos por el núcleo, entonces el radio atómico es cada vez mayor.

Energía de Ionización (EI)
La energía de ionización es la cantidad de energía que tenemos que entregar a un átomo para “ sacarle ” un electrón. Este electrón está en su último Nivel de Energía.
Cuando esto ocurre, el átomo pasa a ser un catión monopositivo, es decir, un átomo con una carga positiva. Esto se llama también Energía de Primera Ionización.
Y lo escribimos como:

También podríamos sacarle un electrón al catión monovalente que obtuvimos antes, convirtiéndolo en un catión divalente. La energía que necesitamos para eso se llama Energía de Segunda Ionización. Y lo escribimos como:
Y lo escribimos como:

Lo mismo podríamos hacer con este nuevo catión divalente, sacándole otro electrón, convirtiéndolo en un catión trivalente. La energía asociada a este proceso se denomina Energía de Tercera Ionización.
Y lo escribimos como:

Para un átomo en particular, cada una de estas energías es mayor que la anterior. Es decir, la Energía Primera Ionización será menor que la Energía de Segunda Ionización, y ésta será menor que la Energía de Tercera ionización.
¿Conoces nuestras clases particulares online? Entérate cómo cientos de estudiantes están cambiando su manera de aprender.
¿Cómo varía la Energía de Ionización en la Tabla Periódica?
Si nos movemos de arriba abajo en un GRUPO, la Energía de Ionización disminuye. Esto es debido a que los átomos tienen cada vez más niveles de energía, por lo que los electrones externos están cada vez más alejados del núcleo. Por lo tanto, cada vez están atraídos con menos fuerza hacia el núcleo ( carga positiva ). Esto hará que sea más fácil "sacarle" un electrón, es decir, habrá que aportar menos cantidad de energía.
Si nos movemos de izquierda a derecha en un PERÍODO, la Energía de Ionización aumenta. Esto es debido a que los electrones se van agregando en un mismo nivel de energía y al mismo tiempo la carga positiva del núcleo es cada vez mayor. El electrón va a estar más atraído y nos va a costar más sacarlo. Por lo tanto la Energía que habrá que aportar para que ocurra el proceso será mayor.

Afinidad Electrónica ó Energía de Unión Electrónica (EUE)
Es la energía que se intercambia cuando un átomo neutro en estado gaseoso gana un electrón para convertirse en un ion mononegativo (es decir, con una carga neta negativa). Los valores de la energía de unión electrónica pueden ser positivos o negativos.
La Afinidad Electrónica será negativa cuando se libere energía. Esto ocurre con átomos que, al captar un electrón, adquieren una configuración electrónica mas estable. Por ejemplo, los Halógenos (Grupo 17 de la Tabla Periódica) tienen 7 electrones en su último nivel de energía. Les falta solamente 1 electrón para cumplir con la Regla del Octeto y adquirir una Configuración Electrónica mas estable (la del gas noble más cercano). El ion formado será mas estable que el átomo neutro. De manera que, será favorable energéticamente el proceso de captar un electrón, y se liberará energía. Por convención, a la energía liberada se le otorga un signo negativo, de modo que la Afinidad Electrónica será negativa.
La Afinidad Electrónica será positiva cuando se requiera aporte de energía. Esto ocurre con átomos que, al captar un electrón NO adquieren una configuración electrónica más estable. Por ejemplo, los elementos del Grupo 2 de la tabla Periódica tienen dos electrones en su último nivel de energía y su configuración electrónica termina con 2 electrones en un subnivel s. De modo que al agregarse un electrón extra, éste deberá ubicarse en un subnivel p que tiene más energía que el s. El ion formado será mas inestable que el átomo neutro. El proceso no será favorable desde el punto de vista energético por lo que requerirá aporte de energía. Por convención, la energía recibida tiene signo positivo, de modo que la Afinidad electrónica será positiva.
¿Cómo varía la Afinidad electrónica en la Tabla Periódica?
Al descender dentro de un GRUPO aumenta el radio atómico, hay menor atracción del núcleo al electrón, entonces habrá menor estabilidad del ion formado, por lo que la Afinidad Electrónica será menor (en valor absoluto, es decir, sin tener en cuenta el signo).
Al movernos de izquierda a derecha dentro de un PERÍODO aumenta Z, es decir, la carga nuclear positiva. De manera que el nuevo electrón se verá más atraído y su ingreso será favorecido, por lo que la Afinidad Electrónica será mayor (en valor absoluto, es decir, sin tener en cuenta el signo).

Radio Iónico
El radio iónico es la distancia que hay desde el núcleo atómico hasta el último nivel de energía de un ion.Verás que se parece mucho a la definición de Radio atómico. Y si! Es básicamente el mismo concepto solo que en este caso lo estamos aplicando a un ion, es decir, un átomo que posee carga neta, ya sea positiva o negativa.
¿Cómo varía el Radio Iónico?
Para átomos de un mismo elemento, se cumple que:
Radio Catiónico < Radio Atómico < Radio Aniónico
- Si a un átomo se le agregan electrones, es decir, pasa a ser un anión va a haber mayor repulsión entre los electrones del ion (Recuerda que las cargas de igual signo se repelen) que la que había entre los electrones del átomo neutro. Esto, lo vemos como una expansión del tamaño, es decir, del radio iónico va a ser mayor para un anión (en comparación con el radio atómico).
- Si a un átomo se le sacan electrones, es decir, pasa a ser un catión va a haber menos apantallamiento y también puede ser que quede un nivel menos de energía, entonces el radio iónico va a ser menor que el radio atómico.
Una regla mnemotécnica para acordarte esto es que cuando se le agregan electrones a un átomo "engorda" (aumenta su radio iónico), y cuando un átomo pierde electrones "adelgaza" (disminuye su radio iónico).
Para iones isoelectrónicos se cumple que:
Cuanto mayor es la carga nuclear (número de protones) menor radio iónico.
Pero, ¿qué son los iones isoelectrónicos? Son iones de distintos elementos (distinto Z=número de protones) que tienen igual número de electrones.
Entonces si comparamos los radios iónicos de dos iones isoelectrónicos veremos que aquel que posea mayor cantidad de protones en su núcleo generará mayor atracción a sus electrones (éstos se acercarán mas al núcleo), lo que provocará que su radio iónico sea menor.
Por ejemplo: Comparemos los radios iónicos del Na+ y el Mg2+
El número Z del Sodio (Na) es 11. Es decir, tiene 11 protones en su núcleo. El ion Na+ tiene una carga positiva, es decir un protón mas que la cantidad de electrones que posea. Como los protones no se ganan ni se pierden y los electrones sí, este ion tendrá 10 electrones y 11 protones.
El número Z del Magnesio (Mg) es 12. Es decir, tiene 12 protones en su núcleo. El ion Mg2+ tiene dos cargas positivas, es decir,dos electrones mas que la cantidad de electrones que posea. Como los protones no se ganan ni se pierden y los electrones sí, este ion tendrá 10 electrones y 12 protones.
Entonces, vemos que dichos iones son isoeletrónicos: ambos tienen 10 electrones, pero uno tiene 11 protones y el otro 12. El ion magnesio tiene mayor carga nuclear (1 protón mas) que el ion sodio, por lo que sus electrones se verán mas fuertemente atraídos hacia el núcleo haciendo que su radio iónico sea menor que el del ion sodio.
¿Conoces nuestras clases particulares online? Entérate cómo cientos de estudiantes están cambiando su manera de aprender.
Electronegatividad
La Electronegatividad es la capacidad de un átomo de atraer electrones a través de un enlace covalente.
La electronegatividad de un átomo determinado está afectada fundamentalmente por dos magnitudes: su masa atómica y el radio atómico . No se puede medir experimentalmente de manera directa como las otras propiedades periódicas, pero puede determinarse de forma indirecta haciendo cálculos a partir de otras propiedades y magnitudes atómicas.
¿Cómo varía la Electronegatividad en la Tabla Periódica?
Si nos movemos hacia abajo en un GRUPO de la tabla periódica, la electronegatividad disminuye.
Si nos movemos de izquierda a derecha dentro de un PERÍODO de la tabla periódica la electronegatividad aumenta.
Elelemento más electronegativo es el Fluor (F) que está en el grupo 17 (a la izquierda de la tabla) y en el período 2 (arriba, en la tabla periódica).
Ten en cuenta que los gases nobles "no cuentan" cuando hablamos de electronegatividad ya que cuando definimos el concepto dijimos que es la capacidad de atraer electrones en un enlace covalente. Los gases nobles no forman enlaces químicos dado que tienen su último nivel de energía con 8 electrones (ó 2 en el caso del Helio) y por lo tanto, son estables.

Autora de este artículo: María Cecilia
Es Bioquímica, da clases particulares de Química, Biología, Biofísica, Bioquímica, Fisiología, Física desde hace 12 años. Nivel secundario, Bachillerato, Terciario y Universitario. Puedes elegir tomar clases particulares online con ella, ya que forma parte de nuestro equipo de profesores.
La clases son de 60 minutos con garantía de satisfacción
Autora de este artículo: María Cecilia
Es Bioquímica, da clases particulares de Química, Biología, Biofísica, Bioquímica, Fisiología, Física desde hace 12 años. Nivel secundario, Bachillerato, Terciario y Universitario. Puedes elegir tomar clases particulares online con ella, ya que forma parte de nuestro equipo de profesores.
La clases son de 60 minutos con garantía de satisfacción
¿Aún tienes dudas con éste u otros temas de química?
¡Puedes tomar clases particulares online mediante videollamada con un profesor y sacarte todas las dudas!